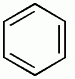
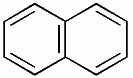
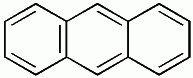
| benzene | naphthalene | anthracene |
 |  |  |
| No of carbons | alkane | alkene | alkyne | cycloalkane |
|---|---|---|---|---|
| 1 | methane | |||
| 2 | ethane | ethene | ethyne | |
| 3 | propane | propene | propyne | cyclopropane |
| 4 | butane | butene | butyne | cyclobutane |
| 5 | pentane | pentene | pentyne | cyclopentane |
| 6 | hexane | hexene | hexyne | cyclohexane |
| 7 | heptane | heptene | heptyne | cycloheptane |
| 8 | octane | octene | octyne | cyclooctane |
| 9 | nonane | nonene | nonyne | cyclononane |
| 10 | decane | decene | decyne | cyclodecane |
| 11 | undecane | undecene | undecyne | cycloundecane |
| 12 | dodecane | dodecene | dodecyne | cyclododecane |
| benzene | naphthalene | anthracene |
 |  |  |
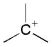
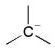
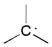
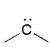
| carbocation | carbanion | radical | carbene |
 |  |  |  |
| 1-AdOMs | OTs/OMs | 1-AdOTs | OTs/Cl | OTs/Br | OTs/I | OTs/Picrate | 2-AdOTs | OTs/OTf | OTs/OCIO |
| 4.17 x 10-3 s-1 | 1.2 | 4.0 x 10-3 s-1 | 5 x 105 | 1.4 x 104 | 6.9 x 103 | 21 | 2.4 x 10-8 s-1 | 1.4 x 10-6 | 1.4 x 10-5 |
| Tosylate | k, s-1 |
| 1-Bicyclo[3.3.2]octyl | 1.2 x 103 |
| 9b-cis,cis,trans-perhydrophenalyl | 1.2 x 102 |
| trans-1-Bicyclo[4.4.0]octyl | 9.1 x 101 |
| 3-Homoadamantyl | 9.4 x 101 |
| 3a-cis,cis,cis-perhydrophenalyl | 3.1 x 101 |
| 1-Bicylo[3.3.1]nonyl | 3.2 |
| 1-Bicylo[3.2.2]nonyl | 7.5 x 10-1 |
| 1-Adamantyl | 4.0 x 10-1 |
| 1-Twistyl | 3.6 x 10-4 |
| 1-Bicyclo[2.2.2]octyl | 1.0 x 10-4 |
| 1-Bicyclo[3.2.1]octyl | 6.8 x 10-6 |
| 10-tricyclo[5.2.1.04,10]dec | 6.9 x 10-7 |
| 1-Noradamantyl | 5.2 x 10-6 |
| 7-Methyl-3-noradamantyl | 1.1 x 10-8 |
| 1-Norbornyl | 4.0 x 10-11 |
| 4-Tricyclo[2.2.1.02,6]heptyl | 3.5 x 10-17 |
| 1-Bicyclo[3.3.3]undecyl | 2.8 x 106 |
| 9b-trans,trans,trans-perhydrophenalyl | 7.0 |
| 6-Protoadamantyl | 6.0 x 10-1 |
| Element | Nulear Spin Quantum Number | Natural Abundance, % | Magnetogyric Ratio, γ, (106 radian/Tesla x Sec) |
|---|---|---|---|
| 1H | 1/2 | 99.98 | 267.53 |
| 2D | 1 | 0.0156 | 41.1 |
| 12C | 0 | 99.9 | |
| 13C | 1/2 | 1.108 | 67.28 |
| 19F | 1/2 | 100.0 | 251.7 |
| 31P | 1/2 | 100.0 | 108.3 |
| Type | 1H, δ, ppm | 13C, δ, ppm |
|---|---|---|
| カルボン酸, COOH | 10-12 | 150-180 |
| アルデヒド, CHO | 9-10 | 180-220 |
| 芳香族, ArH | 7-8 | 120-160 |
| アリファティック, CH, CH2, CH3 | 1-2 | 10-60 |